
Temp??rature
?? propos de ce ??coles s??lection Wikipedia
Cette s??lection se fait pour les ??coles par la charit?? pour enfants lire la suite . Voulez-vous savoir sur le parrainage? Voir www.sponsorachild.org.uk
La temp??rature est un physique propri??t?? d'un syst??me qui sous-tend les notions communes de chaud et de froid; quelque chose qui est g??n??ralement plus chaud a la plus grande temp??rature. Plus particuli??rement, la temp??rature est une mesure de l' ??nergie cin??tique d'un ??chantillon de la mati??re. La temp??rature est un des principaux param??tres de la thermodynamique . A l'??chelle microscopique, la temp??rature est d??finie comme l'??nergie moyenne des mouvements microscopiques d'une seule particule dans le syst??me par degr?? de libert??. A l'??chelle macroscopique, la temp??rature est la propri??t?? physique unique qui d??termine la direction d'??coulement de chaleur entre deux objets plac??s en contact thermique. En l'absence de flux de chaleur se produit, les deux objets ont la m??me temp??rature; autrement la chaleur se ??coule de l'objet plus chaud ?? l'objet plus froid. Ces deux principes fondamentaux sont ??nonc??s dans la droit z??ro et la deuxi??me loi de la thermodynamique, respectivement. Pour un solide, ces mouvements microscopiques sont principalement les vibrations de ses atomes sur leurs sites dans le solide. Pour un gaz monoatomique id??al, les mouvements microscopiques sont les mouvements de translation des particules de gaz constitutifs. Pour un gaz multiatomic, et vibratoire mouvement de rotation devrait ??tre inclus aussi.
La temp??rature est mesur??e avec thermom??tres qui peuvent ??tre calibr?? ?? une vari??t?? de ??chelles de temp??rature. Dans la plupart des pays (?? l'exception du Royaume-Unis , la Jama??que , et quelques autres pays), le degr?? Celsius ??chelle est utilis??e pour la plupart des fins de mesure de temp??rature. L'ensemble du monde scientifique (??tats-Unis inclus) de temp??rature des mesures en utilisant l'??chelle de Celsius et la temp??rature thermodynamique utilisant le kelvin ??chelle, qui est juste ?? l'??chelle Celsius d??cal?? vers le bas de sorte que 0 K = -273,15 ?? C, ou z??ro absolu . De nombreux domaines de l'ing??nierie aux ??tats-Unis, en particulier ceux de haute technologie, utilisent ??galement les ??chelles Celsius et les degr??s kelvin. Toutefois, les ??tats-Unis est le dernier grand pays dans lequel le ??chelle de temp??rature degr?? Fahrenheit est utilis?? par la plupart des profanes, l'industrie, populaire m??t??orologie , et le gouvernement. Autres domaines de l'ing??nierie aux ??tats-Unis se appuient ??galement sur le ??chelle Rankine (une ??chelle Fahrenheit d??cal??) lorsque l'on travaille dans des disciplines thermodynamiques li??s tels que combustion.
Vue d'ensemble
Intuitivement, la temp??rature est une mesure de la fa??on dont quelque chose de chaud ou de froid est, bien que le moyen le plus imm??diat dans lequel nous pouvons mesurer ce, par le sentir, ne est pas fiable, ce qui entra??ne le ph??nom??ne de senti temp??rature de l'air, qui peuvent diff??rer ?? divers degr??s de la temp??rature r??elle. Au niveau mol??culaire, la temp??rature est le r??sultat du mouvement des particules qui forment une substance. Les hausses de temp??rature que l'??nergie de cette motion augmente. Le mouvement peut ??tre le mouvement de translation de la particule, ou l'??nergie interne de la particule en raison de la vibration mol??culaire ou excitation d'un ??lectron le niveau d'??nergie. Bien que les ??quipements de laboratoire tr??s sp??cialis??s est n??cessaire pour d??tecter directement les mouvements de translation, des collisions thermiques thermiques par des atomes ou des mol??cules de petites particules en suspension dans un fluide produit Mouvement brownien qui peut ??tre vu avec un microscope ordinaire. Les mouvements thermiques des atomes sont tr??s rapides et des temp??ratures proches de z??ro absolu sont tenus d'observer directement. Par exemple, lorsque les scientifiques ?? la NIST atteint une temp??rature froide record de 700 nK (1 nK = 10 -9 K) en 1994, ils ont utilis?? Equipement de r??seau optique laser ?? adiabatique fra??ches c??sium atomes. Ils ont ensuite ??teint les lasers et les vitesses de pi??geage d'atomes directement mesur??es de 7 mm par seconde afin de calculer leur temp??rature.
Des mol??cules , telles que O 2, ont plus degr??s de libert?? que les atomes simples: ils peuvent avoir des mouvements de rotation et de vibration ainsi que le mouvement de translation. Une augmentation de la temp??rature provoque l'??nergie de translation moyenne augmente. Il provoque ??galement l'??nergie associ??e ?? des modes de vibration et de rotation augmente. Ainsi, un gaz diatomique, avec des degr??s suppl??mentaires de rotation de la libert?? et de vibrations, n??cessite un apport d'??nergie plus ??lev??e pour changer la temp??rature d'un certain montant, ce est ?? dire qu'il aura un sup??rieur capacit?? thermique d'un gaz monoatomique.
Le processus de refroidissement consiste ?? enlever l'??nergie d'un syst??me. Lorsqu'il n'y a pas plus d'??nergie pouvant ??tre retir??e, le syst??me est dit ??tre au z??ro absolu , qui est le point sur le (absolue) ??chelle de temp??rature thermodynamique , o?? tout mouvement cin??tique dans les particules comprenant la mati??re cesse et ils sont au repos complet en la (non ??classique?? de la m??canique quantique ) sens. Par d??finition, le z??ro absolu est une temp??rature de 0 pr??cis??ment kelvins (-273,15 ?? C ou -459,67 ?? F).
D??tails
| Variables conjugu??es de la thermodynamique | |
|---|---|
| Pression | Volume |
| ( Stress) | ( Strain) |
| Temp??rature | Entropy |
| Potentiel chimique | nombre de particules |
Les propri??t??s formelles de suivi de la temp??rature de sa d??finition math??matique (voir ci-dessous pour la d??finition de la loi de z??ro et la deuxi??me d??finition de la loi) et sont ??tudi??s dans la thermodynamique et la m??canique statistique .
Contrairement ?? d'autres grandeurs thermodynamiques tels que l'entropie et de la chaleur , dont les d??finitions microscopiques sont valables m??me loin de ??quilibre thermodynamique, la temp??rature ??tant une ??nergie moyenne par particule ne peuvent ??tre d??finis ?? l'??quilibre thermodynamique, ou moins ?? l'??quilibre thermodynamique local (voir ci-dessous).
Comme un syst??me re??oit de la chaleur, sa temp??rature augmente; de m??me, une perte de chaleur du syst??me tend ?? diminuer sa temp??rature (au - rare - exception de temp??rature n??gative; voir ci-dessous).
Lorsque deux syst??mes sont ?? la m??me temp??rature, pas de transfert de chaleur se produit entre eux. Quand une diff??rence de temp??rature existe, la chaleur aura tendance ?? se d??placer du syst??me de -temp??rature ??lev??e au syst??me de -temp??rature inf??rieur, jusqu'?? ce qu'ils soient ?? l'??quilibre thermique. Ce transfert de chaleur peut se produire par l'interm??diaire conduction, convection ou rayonnement ou des combinaisons d'entre eux (voir la chaleur de discussion suppl??mentaire des divers m??canismes de transfert de chaleur) et certains ions peuvent varier.
La temp??rature est ??galement li??e ?? la quantit?? de l'??nergie interne et enthalpie d'un syst??me: plus la temp??rature d'un syst??me, plus son ??nergie interne et enthalpie.
La temp??rature est un propri??t?? intensive d'un syst??me, ce qui signifie qu'elle ne d??pend pas de la taille du syst??me, la quantit?? ou le type de mat??riau dans le syst??me, la m??me que pour la la pression et la densit?? . En revanche, la masse , le volume , et l'entropie sont propri??t??s ??tendues, et d??pendent de la quantit?? de mati??re dans le syst??me.
Le r??le de la temp??rature dans la nature

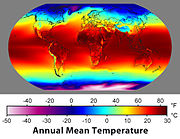
La temp??rature joue un r??le important dans presque tous les domaines de la science, y compris la physique, la chimie et la biologie.
De nombreuses propri??t??s physiques des mat??riaux, y compris l' ??tape ( solide , liquide , gazeuse ou plasma ), la densit?? , la solubilit?? , la pression de vapeur, et la conductivit?? ??lectrique d??pend de la temp??rature. La temp??rature joue ??galement un r??le important dans la d??termination du taux et de l'??tendue ?? laquelle des r??actions chimiques se produisent. Ce est une des raisons pourquoi le corps humain a plusieurs m??canismes ??labor??s pour maintenir la temp??rature ?? 37 ?? C, car les temp??ratures ?? seulement quelques degr??s de plus peuvent entra??ner des r??actions nocives avec des cons??quences graves. Temp??rature commande ??galement le type et la quantit?? de rayonnement thermique ??mis par une surface. Une application de cet effet est la ampoule ?? incandescence, dans lequel un tungst??ne filament est ??lectriquement chauff?? ?? une temp??rature ?? laquelle des quantit??s significatives de visible de lumi??re sont ??mis.
Temp??rature de la d??pendance vitesse du son dans l'air c, ρ la densit?? de l'air et l'imp??dance acoustique Z vs. la temp??rature ?? C
| Effet de la temp??rature sur la vitesse du son, la densit?? de l'air et de l'imp??dance acoustique | |||
| T en ?? C | c en m / s | ρ en kg / m?? | Z en N ?? s / m?? |
| -10 | 325,4 | 1,341 | 436,5 |
| -5 | 328,5 | 1,316 | 432,4 |
| 0 | 331,5 | 1,293 | 428,3 |
| 5 | 334,5 | 1,269 | 424,5 |
| 10 | 337,5 | 1,247 | 420,7 |
| 15 | 340,5 | 1,225 | 417,0 |
| 20 | 343,4 | 1,204 | 413,5 |
| 25 | 346,3 | 1,184 | 410,0 |
| 30 | 349,2 | 1,164 | 406,6 |
Mesure de la temp??rature
Mesure de la temp??rature ?? l'aide scientifique moderne thermom??tres et ??chelles de temp??rature remonte au moins aussi loin que le d??but du 18e si??cle, lorsque Gabriel Fahrenheit adapt?? un thermom??tre (passage ?? mercure ) et une ??chelle ?? la fois d??velopp?? par Ole Christensen R??mer. L'??chelle de Fahrenheit est encore en usage, aux c??t??s de l' Celsius ??chelle et le kelvin ??chelle.
Unit??s de temp??rature
L'unit?? de base de la temp??rature (symbole: T) dans le Syst??me international d'unit??s (SI) est le kelvin (Symbole: K). Le kelvin et Celsius (centigrades) ??chelles sont, par accord international, d??finie par deux points: z??ro absolu et la triple point de Norme Mean Ocean Water Vienne (eau sp??cialement pr??par??e avec un m??lange sp??cifi?? de l'hydrog??ne et l'oxyg??ne isotopes). Z??ro absolue est d??finie comme ??tant pr??cis??ment K 0 et -273,15 ?? C. Le z??ro absolu est o?? tous mouvement cin??tique dans les particules comprenant la mati??re cesse et ils sont au repos complet dans la (non ??classique?? de la m??canique quantique ) sens. Au z??ro absolu, la mati??re ne contient energie thermique. En outre, le point triple de l'eau est d??finie comme ??tant pr??cis??ment 273,16 K et 0,01 ?? C. Cette d??finition fait trois choses: 1) qu'il fixe l'ampleur de l'unit?? de kelvin comme ??tant pr??cis??ment une part ?? 273,16 pi??ces la diff??rence entre le z??ro absolu et le point triple de l'eau; 2) il ??tablit que l'un kelvin a pr??cis??ment la m??me ampleur comme une augmentation d'un degr?? sur le Celsius ??chelle; et 3) il ??tablit la diff??rence entre les points nuls des deux balances comme ??tant pr??cis??ment 273,15 kelvins (K = 0 -273,15 ?? C et 273,16 K = 0,01 ?? C). Formules pour la conversion de ces unit??s d??finissant de temp??rature ?? d'autres ??chelles peuvent ??tre trouv??s ?? formules de conversion de temp??rature.
Dans le domaine de la physique des plasmas , en raison des temp??ratures ??lev??es rencontr??es et la ??lectromagn??tique nature des ph??nom??nes mis en jeu, il est habituel d'exprimer la temp??rature en ??lectronvolts (eV) ou kilo??lectronvolts (keV), o?? 1 eV = 11 604 K. Dans l'??tude de QCD importe l'on rencontre r??guli??rement des temp??ratures de l'ordre de quelques centaines MeV, ce qui ??quivaut ?? environ 10 12 K.
Pour les applications de tous les jours, il est tr??s souvent commode d'utiliser l' Celsius ??chelle, dans lequel 0 ?? C correspond ?? la temp??rature ?? laquelle l'eau g??le et 100 ?? C correspond ?? la temp??rature d'??bullition de l'eau au niveau de la mer. Dans cette ??chelle une diff??rence de temp??rature de 1 degr?? est identique ?? une diff??rence de temp??rature de 1 K, de sorte que l'??chelle est essentiellement la m??me que l'??chelle de Kelvin, mais compens??e par la temp??rature ?? laquelle l'eau g??le (273,15 K). Ainsi, l'??quation suivante peut ??tre utilis??e pour convertir des degr??s Celsius en kelvins.
Au Etats-Unis , la Fahrenheit est largement utilis??. Sur cette ??chelle, le point de cong??lation de l'eau correspond ?? 32 ?? F et le point ?? 212 ?? F d'??bullition. La formule suivante peut ??tre utilis?? pour convertir de Fahrenheit ?? Celsius:
Voir formules de conversion de temp??rature pour les conversions entre la plupart des ??chelles de temp??rature.
Les temp??ratures n??gatives
Pour certains syst??mes et les d??finitions sp??cifiques de temp??rature, il est possible d'obtenir une temp??rature n??gative. Un syst??me avec une temp??rature n??gative ne est pas plus froid que le z??ro absolu , mais il se agit plut??t, en un sens, plus chaud que temp??rature infinie.
Comparaison des ??chelles de temp??rature
| Commentaire | Kelvin K | Celsius ?? C | Fahrenheit ?? F | Rankine ?? Ra (?? R) | Delisle ?? D ?? | Newton N ?? | R??aumur ?? R (?? R??, ?? Re) ?? | R??mer ?? R?? (?? R) ?? |
|---|---|---|---|---|---|---|---|---|
| Z??ro absolu | 0 | -273,15 | -459,67 | 0 | 559,725 | -90,14 | -218,52 | -135,90 |
| La plus basse temp??rature naturelle enregistr??e sur Terre ( Vostok, Antarctique - le 21 Juillet 1983) | 184 | -89 | -128 | 331 | 284 | -29 | -71 | -39 |
| Celsius / "cross-over" temp??rature de Fahrenheit | 233,15 | -40 | -40 | 419,67 | 210 | -13,2 | -32 | -13,5 |
| M??lange de glace / sel de Fahrenheit | 255,37 | -17,78 | 0 | 459,67 | 176,67 | -5,87 | -14,22 | -1,83 |
| L'eau g??le (?? pression standard) | 273,15 | 0 | 32 | 491,67 | 150 | 0 | 0 | 7,5 |
| La temp??rature moyenne ?? la surface de la Terre | 288 | 15 | 59 | 519 | 128 | 5 | 12 | 15 |
| Moyenne temp??rature du corps humain ?? | 310,0 ?? 0,7 | 36,8 ?? 0,7 | 98,2 ?? 1,3 | 557,9 ?? 1,3 | 94,8 ?? 1,1 | 12,1 ?? 0,2 | 29,4 ?? 0,6 | 26,8 ?? 0,4 |
| La plus haute temp??rature de surface enregistr??e sur Terre ( El Azizia, en Libye - le 13 Septembre 1922) Mais que la lecture est interrog??. | 331 | 58 | 136 | 596 | 63 | 19 | 46 | 38 |
| L'eau bout (au pression standard) | 373,15 | 100 | 212 | 672 | 0 | 33 | 80 | 60 |
| Gaz flamme | ~ 1773 | ~ 1500 | ~ 2732 | |||||
| Titanium fond | 1941 | 1668 | 3034 | 3494 | -2352 | 550 | 1334 | 883 |
| Le surface du Soleil | 5800 | 5526 | 9980 | 10440 | -8140 | 1823 | 4421 | 2909 |
1 L'??chelle de temp??rature est tomb?? en d??su??tude, et de simple int??r??t historique.
2 La temp??rature normale du corps humain est de 36,8 ?? 0,7 ?? C, ou de 98,2 ?? 1,3 ?? C. La valeur couramment donn?? 98,6 ?? F est tout simplement la conversion exacte du XIXe si??cle allemand norme de 37 ?? C. Comme il ne mentionne pas une fourchette acceptable, il pourrait donc ??tre consid??r?? comme ayant un exc??s (invalide) pr??cision. Voir Temp??rature de la sant?? humaine (Body Temp??rature) pour plus d'informations.
Certains chiffres de ce tableau ont ??t?? arrondis.
Fondement th??orique de la temp??rature
D??finition Zeroth-loi de la temp??rature
Alors que la plupart des gens ont une compr??hension de base du concept de la temp??rature, sa d??finition formelle est assez compliqu??. Avant de sauter ?? une d??finition formelle, consid??rons le concept de ??quilibre thermique. Si deux syst??mes avec des volumes fixes sont r??unis en contact thermique, les changements seront tr??s probablement lieu dans les propri??t??s des deux syst??mes. Ces changements sont provoqu??s par le transfert de chaleur entre les syst??mes. Un ??tat doit ??tre atteint dans laquelle aucun autre changement, pour mettre les objets en ??quilibre thermique.
Une base pour la d??finition de la temp??rature peut ??tre obtenue ?? partir de la Principe z??ro de la thermodynamique qui stipule que si deux syst??mes, A et B, sont en ??quilibre thermique et un troisi??me syst??me C est en ??quilibre thermique avec le syst??me A alors syst??mes B et C seront ??galement en ??quilibre thermique (??tant en ??quilibre thermique est un relation transitive; en outre, ce est un relation d'??quivalence ). Ce est un fait empirique, bas??e sur l'observation plut??t que la th??orie. Depuis A, B, et C sont tous en ??quilibre thermique, il est raisonnable de dire chacun de ces syst??mes part une valeur commune de certains biens. Nous appelons cette temp??rature de la propri??t??.
En r??gle g??n??rale, il ne est pas commode de placer des deux syst??mes en contact thermique arbitraires pour voir si elles sont en ??quilibre thermique et ont donc la m??me temp??rature. En outre, il serait seulement fournir une ??chelle ordinale.
Par cons??quent, il est utile d'??tablir une ??chelle de temp??rature bas?? sur les propri??t??s de certains syst??me de r??f??rence. Ensuite, un dispositif de mesure peut ??tre ??talonn?? en fonction des propri??t??s du syst??me de r??f??rence et utilis??e pour mesurer la temp??rature des autres syst??mes. Un tel syst??me de r??f??rence est une quantit?? fixe de gaz. Le loi des gaz parfaits indique que le produit de la pression et de volume (P ?? V) d'un gaz est directement proportionnelle ?? la temp??rature:
 (1)
(1)
o?? T est la temp??rature, n est le nombre de moles de gaz et R est la constante des gaz. Ainsi, on peut d??finir une ??chelle de temp??rature en fonction de la pression et le volume de gaz correspondant: la temp??rature en kelvins est la pression en pascals de une mole de gaz dans un r??cipient de un m??tre cube, divis??e par 8,31 ... En pratique, , un tel thermom??tre ?? gaz ne est pas tr??s pratique, mais d'autres instruments de mesure peut ??tre calibr?? pour cette ??chelle.
Il est ??galement int??ressant de noter que la pression, le volume et le nombre de moles d'une substance sont tous intrins??quement sup??rieure ou ??gale ?? z??ro. Ceci sugg??re que la temp??rature doit ??tre sup??rieure ou ??gale ?? z??ro. En pratique il ne est pas possible d'utiliser un thermom??tre ?? gaz pour mesurer la temp??rature de z??ro absolu depuis les gaz ont tendance ?? se condenser en un liquide longue avant que la temp??rature atteint z??ro. Il est possible d'extrapoler le nombre de degr??s au-dessous de la temp??rature actuelle du z??ro absolu est de la gamme de temp??rature o?? une ??quation de travaux.
Temp??rature des gaz
Pour un le gaz id??al th??orie cin??tique des gaz utilise la m??canique statistique de relier la temp??rature ?? l'??nergie cin??tique moyenne des atomes dans le syst??me. Cette ??nergie moyenne est ind??pendante de la masse des particules, ce qui semble contre-intuitif ?? de nombreuses personnes. Temp??rature est li??e uniquement ?? l'??nergie cin??tique moyenne des particules dans un gaz - chaque particule a sa propre ??nergie qui peuvent ou peuvent ne pas correspondre ?? la moyenne; la distribution des ??nergies (et donc les vitesses) des particules dans ne importe quel gaz sont donn??s par la Distribution de Maxwell-Boltzmann. La temp??rature d'un gaz parfait est li?? ?? son ??nergie cin??tique moyenne par l'??quation:
 O??
O??  (N = nombre de moles, R = constante des gaz parfaits).
(N = nombre de moles, R = constante des gaz parfaits).
Dans le cas d'un gaz monoatomique, l' ??nergie cin??tique est:
(A noter que le calcul de l'??nergie cin??tique d'un objet plus complexe, tel qu'une mol??cule, est un peu plus complexe. Plus degr??s de libert?? sont disponibles, rotation de mani??re mol??culaire ou les vibrations doivent ??tre inclus.)
La deuxi??me loi de la thermodynamique affirme que les deux syst??mes donn??s lors de l'interaction avec l'autre seront ensuite atteindre la m??me ??nergie moyenne par particule (et donc la m??me temp??rature). Dans un m??lange de particules de masse diff??rents, les particules les plus lourdes se d??placent plus lentement que leurs homologues plus l??gers, mais auront toujours la m??me ??nergie moyenne. Un n??on atome se d??place plus lentement par rapport ?? un atome d'hydrog??ne mol??cule de la m??me ??nergie cin??tique; une particule de pollen se d??place dans une lente Mouvement brownien entre les mol??cules d'eau en mouvement rapide, etc. Une illustration visuelle de ce de l'Oklahoma State University fait le point plus clair. Particules avec masse diff??rente ont des distributions de vitesse, mais l'??nergie cin??tique moyenne est la m??me en raison de la loi des gaz parfaits.
Temp??rature du vide
Il est possible d'utiliser la d??finition de la loi z??ro de la temp??rature d'assigner une temp??rature de quelque chose que nous ne associons pas normalement avec des temp??ratures, comme un vide parfait. Parce que tous les objets ??mettent rayonnement du corps noir, un thermom??tre dans un vide loin de sources de rayonnement thermique va rayonner sa propre ??nergie thermique; diminution de la temp??rature ind??finiment jusqu'?? ce qu'il atteigne la limite d'??nergie du point z??ro. A ce stade, il peut ??tre dit ??tre en ??quilibre avec le vide et, par d??finition, ?? la m??me temp??rature. Si nous pouvions trouver un gaz qui se est comport?? parfaitement tout le long du z??ro absolu de la th??orie cin??tique des gaz nous dit qu'il permettrait d'atteindre z??ro ??nergie cin??tique par particule, et atteindre ainsi la temp??rature du z??ro absolu. Ainsi, par la loi z??ro, un vide isol?? parfait est ?? la temp??rature du z??ro absolu. A noter que, pour se comporter de pr??f??rence dans ce contexte, il est n??cessaire que les atomes du gaz ne ont pas ?? l'??nergie du point z??ro. Il tournera pas ?? la mati??re que ce ne est pas possible parce que la deuxi??me d??finition de la loi de la temp??rature donnera le m??me r??sultat pour tout ??tat de vide unique.
Plus r??aliste, pas tel vide id??al existe. Par exemple, un thermom??tre dans une chambre ?? vide qui est maintenu ?? une certaine temp??rature finie (par exemple, la chambre se trouve dans le laboratoire ?? temp??rature ambiante) se ??quilibrer avec le rayonnement thermique qu'il re??oit de la chambre et dans le temps atteint la temp??rature de la chambre. Si une orbite autour de la Terre thermom??tre est expos?? ?? une lumi??re du soleil , puis il se ??quilibre ?? la temp??rature ?? laquelle la puissance re??ue par le thermom??tre du soleil est exactement ??gale ?? la puissance rayonn??e par une distance le rayonnement thermique du thermom??tre. Pour un corps noir cette temp??rature d'??quilibre est d'environ 281 K (8 ?? C). Temp??rature moyenne de la Terre (qui est maintenu par l'??quilibre similaire) est proche de cette temp??rature.
Un thermom??tre isol?? du rayonnement solaire (?? l'ombre de la Terre, par exemple) est toujours expos??e au rayonnement thermique de la Terre - va donc montrer une certaine temp??rature d'??quilibre au cours de laquelle il re??oit et ??met quantit?? ??gale de l'??nergie. Si ce thermom??tre est proche de la Terre, puis sa temp??rature d'??quilibre est d'environ 236 K (-37 ?? C) ?? condition que la surface de la Terre est ?? 281 K.
Un thermom??tre loin de syst??me solaire re??oit toujours Cosmic rayonnement de fond . temp??rature d'??quilibre d'un tel thermom??tre est d'environ 2,725 K, qui est la temp??rature d'un gaz de photons constituant corps noir micro-ondes rayonnement de fond ?? l'??tat actuel de l'expansion de l'Univers. Cette temp??rature est parfois appel??e la temp??rature de l'espace.
D??finition Second-loi de la temp??rature
Dans la section pr??c??dente temp??rature a ??t?? d??finie en termes de la Loi Z??ro de la thermodynamique. Il est ??galement possible de d??finir la temp??rature en fonction de la seconde loi de la thermodynamique , qui traite de l'entropie . L'entropie est une mesure du trouble dans un syst??me. La deuxi??me loi stipule que tout processus entra??nera aucun changement ou une augmentation nette de l'entropie de l'univers. Ceci peut ??tre compris en termes de probabilit??. Consid??rons une s??rie de lancers de pi??ces. Un syst??me parfaitement ordonn?? serait celui dans lequel chaque tirage soit arrive t??tes ou tous toss arrive queues. Cela signifie que pour un ensemble parfaitement ordonn?? de lancers de pi??ces, il ya un seul ensemble de toss r??sultats possibles: le jeu dans lequel 100% de lancers est venu le m??me.
D'autre part, il existe plusieurs combinaisons qui peuvent entra??ner des syst??mes d??sordonn??s ou mixtes, o?? une fraction sont t??tes et les queues de repos. Un syst??me d??sordonn?? peut ??tre 90% et 10% t??tes queues, ou ce pourrait ??tre 40% et 60% t??tes queues, et cetera. Comme le nombre de pi??ce jette augmente, le nombre de combinaisons possibles correspondant aux ordonn?? imparfaitement syst??mes augmente. Pour un tr??s grand nombre de lancers de pi??ces, le nombre de combinaisons correspondant ?? ~ 50% ~ 50 t??tes et queues domine% et l'obtention d'un r??sultat significativement diff??rente de 50/50 devient extr??mement improbable. Ainsi, le syst??me progresse naturellement ?? un ??tat de d??sordre maximum ou entropie.
Nous avons dit pr??c??demment que la temp??rature contr??le le flux de chaleur entre deux syst??mes et nous venons de montrer que l'univers, et nous nous attendons ?? tout syst??me naturel, a tendance ?? progresser de mani??re ?? maximiser l'entropie. Ainsi, nous nous attendons qu'il y ait une relation entre la temp??rature et l'entropie. Afin de trouver d'abord examiner la relation de cette relation entre la chaleur let, le travail et la temp??rature. Un moteur thermique est un dispositif de conversion de chaleur en travail m??canique et de l'analyse de la Cycle de Carnot fournit les relations n??cessaires que nous recherchons. Le travail d'un moteur thermique correspond ?? la diff??rence entre la chaleur mis dans le syst??me ?? la temp??rature ??lev??e, q H et ??ject?? de la chaleur ?? basse temp??rature, q C. L'efficacit?? est le travail divis?? par la chaleur mis dans le syst??me ou:
 (2)
(2)
o?? w cy est le travail effectu?? par cycle. Nous voyons que l'efficacit?? ne d??pend que de q C / q H. Parce q C et q H correspondent au transfert de chaleur aux temp??ratures T et T C H, respectivement, q C / q H devrait ??tre une fonction de ces temp??ratures:
 (3)
(3)
Le th??or??me de Carnot stipule que tous les moteurs r??versibles fonctionnant entre les m??mes r??servoirs de chaleur sont ??galement efficaces. Ainsi, un moteur thermique fonctionnant entre T 1 et T 3 doit avoir la m??me efficacit?? que l'un consistant en deux cycles, une entre T 1 et T 2, et le second entre T 2 et T 3. Cela ne peut ??tre le cas si:
ce qui implique:
Depuis la premi??re fonction est ind??pendante de T 2, cette temp??rature doit annuler sur le c??t?? droit, ce qui signifie f (T 1, T 3) est de la forme g (T 1) / g (T 3) (c.-??-f (T 1, T 3) = f (T 1, T 2) f (T 2, T 3) = g (T 1) / g (T 2) ?? g (T 2) / g (T 3) = g (T 1) / g (T 3)), o?? g est une fonction d'une temp??rature unique. Nous pouvons maintenant choisir une ??chelle de temp??rature avec la propri??t?? que:
 (4)
(4)
Substituant l'??quation 4 ?? l'arri??re dans l'??quation 2 donne une relation pour l'efficacit?? en termes de temp??rature:
 (5)
(5)
Notez que T C = 0 K l'efficacit?? est de 100% et que l'efficacit?? devient sup??rieur ?? 100% en dessous de 0 K. Depuis un rendement sup??rieur ?? 100% viole la premi??re loi de la thermodynamique, cela implique que 0 K est la temp??rature minimale possible. En fait, la temp??rature la plus basse jamais obtenu dans un syst??me macroscopique ??tait de 20 nK, qui a ??t?? r??alis?? en 1995 au NIST. En soustrayant le c??t?? droit de l'??quation 5 de la partie m??diane et r??arrangement donne:
o?? le signe n??gatif indique thermique ??ject?? du syst??me. Cette relation sugg??re l'existence d'une fonction d'??tat, S, d??finie par:
 (6)
(6)
o?? l'indice indique un processus r??versible. Le changement de cette fonction de l'Etat autour de ne importe quel cycle est ??gal ?? z??ro, comme ce est n??cessaire pour toute fonction d'??tat. Cette fonction correspond ?? l'entropie du syst??me, que nous avons d??crite pr??c??demment. Nous pouvons r??organiser l'??quation 6 pour obtenir une nouvelle d??finition de la temp??rature en termes d'entropie et de la chaleur:
 (7)
(7)
Pour un syst??me o?? l'entropie S peut ??tre une fonction S (E) de son ??nergie E, la temp??rature T est donn??e par:
 (8)
(8)
ie. l'inverse de la temp??rature est le taux d'augmentation de l'entropie par rapport ?? l'??nergie.

![\ Mathrm {K = [^ \ circ C] \ left (\ frac {1 \, K} {1 \, ^ \ circ C} \ right) + 273,15 \, K}](../../images/134/13419.png)





