
Num??ro atomique
Contexte des ??coles Wikip??dia
Enfants SOS offrent un chargement complet de la s??lection pour les ??coles pour une utilisation sur les intranets des ??coles. Le parrainage d'enfants aide les enfants un par un http://www.sponsor-a-child.org.uk/ .
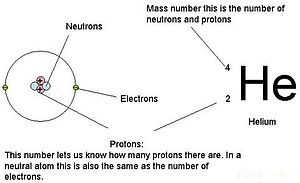
Dans la chimie et la physique , le num??ro atomique (??galement connu comme le nombre de protons) est le nombre de protons pr??sents dans le noyau d'un atome et donc identique ?? la charger num??ro du noyau. Il est classiquement repr??sent??e par le symbole Z. Le num??ro atomique identifie de mani??re unique un ??l??ment chimique . Dans un atome de charge neutre , le num??ro atomique est ??gal au nombre d' ??lectrons .
Le num??ro atomique Z, ne doit pas ??tre confondu avec le nombre de masse, A, qui est le nombre de nucl??ons, le nombre total de protons et de neutrons dans le noyau d'un atome. Le nombre de neutrons, N, est connu comme le nombre de neutrons de l'atome; Ainsi, A = Z + N (ces quantit??s sont toujours des nombres entiers ). Etant donn?? que les protons et les neutrons ont approximativement la m??me masse (et la masse des ??lectrons est n??gligeable de nombreux cas), et le d??faut de masse de la liaison nucl??on est toujours faible par rapport ?? la masse des nucl??ons, le masse atomique de tout atome, lorsqu'elle est exprim??e en unifi??s unit??s de masse atomique (fabrication une quantit?? appel??e le " de masse isotopique relative, ") est ?? peu pr??s (?? 1%) ??gal au nombre entier A.
Atomes ayant le m??me num??ro atomique Z mais nombre diff??rent de neutrons N, et par cons??quent diff??rentes masses atomiques, sont connus comme des isotopes . Un peu plus de trois quarts des ??l??ments naturels existent comme un m??lange d'isotopes (voir monoisotopiques ??l??ments), et la masse isotopique moyenne d'un m??lange isotopique d'un ??l??ment (appel?? la masse atomique relative) dans un environnement d??fini sur Terre, d??termine le niveau de l'??l??ment poids atomique. Historiquement, ce sont ces masses atomiques des ??l??ments (par rapport ?? l'hydrog??ne) qui ??taient les quantit??s mesurables par les chimistes dans le 19 e si??cle.
Le symbole Z classique provient de l' allemand mot num??ro de sens ahl Z / num??rique / figure, qui, avant la synth??se moderne des id??es de la chimie et de la physique, simplement not??e lieu num??rique d'un ??l??ment dans le tableau p??riodique , une propri??t?? plus ou moins d??termin?? par atomique des poids, mais pas dans tous les cas (voir ci-dessous). Ce est seulement apr??s 1915, avec la suggestion et la preuve que ce num??ro de Z a ??galement la charge nucl??aire et une caract??ristique physique des atomes, a fait le mot Atom z ahl et son num??ro atomique ??quivalent anglais entrent en usage courant.
Histoire
Le tableau p??riodique et un nombre naturel de chaque ??l??ment

Grosso modo, l'existence ou la construction d'un tableau p??riodique des ??l??ments cr??e une commande pour les ??l??ments. Cette commande ne est pas n??cessairement une num??rotation, mais il peut ??tre utilis?? pour construire une num??rotation par d??cret (ce est ?? dire, tout simplement statuant que les ??l??ments soient donn??s nombres entiers accoding ?? leur place sur la table, en commen??ant par l'hydrog??ne comme ??num??ro un."
Dmitri Mendele??ev a affirm?? qu'il arrang?? ses premiers tableaux p??riodiques afin de poids atomique ("Atomgewicht") Cependant, par respect pour les propri??t??s chimiques observ??s, il a viol?? sa propre r??gle et plac?? tellure (poids atomique 127,6) avant de l'iode (poids atomique 126,9). Ce placement est conforme ?? la pratique moderne de commander les ??l??ments par nombre de protons, Z, mais ce nombre ne est pas connu ou suspect?? ?? l'??poque.
Cependant, une num??rotation simple bas?? sur la position de la table p??riodique n'a jamais ??t?? tout ?? fait satisfaisante,. Outre le cas de l'iode et le tellure, plus tard, plusieurs autres paires d'??l??ments (tels que l'argon et le potassium, le cobalt et le nickel) ont ??t?? connus pour avoir des poids atomiques presque identiques ou invers??es, laissant parfois leur placement dans le tableau p??riodique par des propri??t??s chimiques pour ??tre en violation de propri??t??s physiques connues. Un autre probl??me ??tait que l'identification progressive de plus en plus chimiquement semblables et indiscernables lanthanides , qui ??taient d'un nombre incertain, a conduit ?? l'incoh??rence et de l'incertitude dans la num??rotation p??riodique des ??l??ments au moins de lut??tium (??l??ment 71) partir ( hafnium ne ??tait pas connu au cette fois).



Le mod??le de Rutherford-Bohr et van den Broek
En 1911, Ernest Rutherford a donn?? une mod??le de l'atome dans lequel un noyau central a tenu plus de la masse de l'atome et une charge positive qui, dans les unit??s de la charge de l'??lectron, devait ??tre ?? peu pr??s ??gal ?? la moiti?? du poids atomique de l'atome, exprim?? en nombre d'atomes d'hydrog??ne. Cette charge centrale serait donc environ la moiti?? du poids atomique (si ce ??tait pr??s de 25% diff??rent du num??ro atomique de l'or (Z = 79, A = 197), l'??l??ment unique ?? partir duquel Rutherford a fait sa proposition). N??anmoins, en d??pit de l'estimation de Rutherford que l'or avait une charge centrale d'environ 100 (mais ??tait l'??l??ment Z = 79 sur le tableau p??riodique), un mois apr??s le document de Rutherford est apparu, Antonius van den Broek premier formellement sugg??r?? que la charge centrale et le nombre d'??lectrons dans un atome ??tait exactement ??gale ?? sa place dans le tableau p??riodique (??galement connu sous le num??ro de l'??l??ment, de num??ro atomique, et symbolis?? Z). Cela se est av??r?? par la suite ??tre le cas.
1913 exp??rience de Moseley
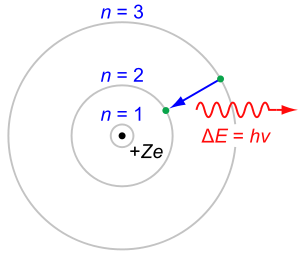
La situation exp??rimentale am??lior??e de fa??on spectaculaire apr??s des recherches par Henry Moseley en 1913. Moseley, apr??s des discussions avec Bohr qui ??tait au m??me laboratoire (et qui avaient utilis?? l'hypoth??se de Van den Broek dans son Bohr mod??le de l'atome), a d??cid?? de tester l'hypoth??se Van den Broek et Bohr directement, en voyant si raies spectrales ??mises par les atomes excit??s se adaptent ?? la demande de la th??orie de Bohr que la fr??quence des raies spectrales soit proportionnelle ?? une mesure de la place de Z.
Pour ce faire, Moseley mesur?? les longueurs d'onde des transitions de photons plus ?? l'int??rieur (lignes K et L) produits par les ??l??ments de l'aluminium (Z = 13) ?? l'or (Z = 79) utilis?? comme une s??rie de cibles mobiles ?? l'int??rieur d'un anodiques tube ?? rayons X. La racine carr??e de la fr??quence de ces photons (rayons X) a augment?? d'une cible ?? l'autre de fa??on lin??aire. Cela a conduit ?? la conclusion ( La loi de Moseley) que le num??ro atomique ne correspond ??troitement (avec un d??calage d'une unit?? pour K-lignes, dans le travail de Moseley) au calcul??e charge ??lectrique du noyau, ?? savoir le num??ro de l'??l??ment Z. Entre autres choses, Moseley d??montr?? que la lanthanides s??rie (de lanthane au lut??tium inclus) doit avoir 15 membres-pas moins et pas plus, qui ??tait loin d'??tre ??vident de la chimie ?? ce moment-l??.
Le proton et l'id??e d'??lectrons nucl??aires
En 1915, la raison de la charge nucl??aire ??tant quantifi?? en unit??s de Z, qui sont d??sormais reconnus pour ??tre le m??me que le num??ro de l'??l??ment, n'a pas ??t?? comprise. Une vieille id??e appel??e L'hypoth??se de Prout avait postul?? que les ??l??ments sont tous faits de r??sidus (ou "protyles") de l'??l??ment le plus l??ger de l'hydrog??ne, qui, dans le mod??le de Bohr-Rutherford avait un seul ??lectron et une charge nucl??aire d'un. Cependant, d??s 1907 et Rutherford Thomas Royds avait montr?? que les particules alpha, qui avaient une charge de deux, ??taient les noyaux des atomes d'h??lium, qui avaient une masse quatre fois sup??rieure ?? celle de l'hydrog??ne, et non pas deux fois. Si l'hypoth??se de Prout ??tait vrai, quelque chose devait ??tre neutraliser une partie de la charge des noyaux d'hydrog??ne pr??sents dans les noyaux des atomes plus lourds.
En 1917, Rutherford a succ??d?? ?? g??n??rer des noyaux d'hydrog??ne ?? partir d'un r??action nucl??aire entre les particules alpha et de l'azote gazeux, et croyait avoir prouv?? la loi de Prout. Il a appel?? les nouvelles particules lourdes nucl??aires protons en 1920 (noms de suppl??ants ??tant proutons et protyles). Il avait ??t?? imm??diatement apparente du travail de Moseley que les noyaux d'atomes lourds ont plus de deux fois plus de masse comme on pouvait s'y attendre de leur ??tre faite de noyaux d'hydrog??ne, et donc il ??tait n??cessaire une hypoth??se pour la neutralisation des protons suppl??mentaires pr??sum??e Pr??sent dans tous les noyaux lourds. Un noyau d'h??lium a ??t?? pr??sum?? ??tre compos?? de quatre protons et de deux ????lectrons nucl??aires" (??lectrons li??s dans le noyau) pour annuler deux des charges. A l'autre extr??mit?? de la table p??riodique, un noyau d'or ayant une masse 197 fois celui de l'hydrog??ne, a ??t?? pens?? pour contenir 118 ??lectrons nucl??aires dans le noyau pour lui donner une charge r??siduelle de 79 +, en accord avec son nombre atomique.
La d??couverte du fait neutrons Z le nombre de protons
Tout examen des ??lectrons nucl??aires a pris fin avec la d??couverte de Chadwick du neutron en 1932. Un atome d'or ??tait maintenant consid??r??e comme contenant 118 neutrons plut??t que 118 ??lectrons nucl??aires, et sa charge positive aujourd'hui a ??t?? r??alis?? ?? venir enti??rement ?? partir d'un contenu de 79 protons. Apr??s 1932, par cons??quent, le nombre atomique d'un ??l??ment Z a ??galement ??t?? r??alis?? pour ??tre identique au nombre de protons des noyaux.
Le symbole de Z
Le symbole Z classique vient peut-??tre de l' allemand mot Atom z ahl (num??ro atomique). Cependant, avant 1915, le mot Zahl (tout simplement le num??ro) a ??t?? utilis?? pour le num??ro attribu?? ?? un ??l??ment dans le tableau p??riodique.
Propri??t??s chimiques
Chaque ??l??ment poss??de un ensemble sp??cifique de propri??t??s chimiques du fait du nombre d'??lectrons pr??sents dans l'atome neutre, ce qui est Z (num??ro atomique). Le configuration de ces ??lectrons r??sulte des principes de la m??canique quantique . Le nombre d'??lectrons dans chaque ??l??ment de couches ??lectroniques, en particulier les r??gions ultrap??riph??riques valence shell, est le facteur principal dans la d??termination de sa liaison chimique comportement. Par cons??quent, il est le seul num??ro atomique qui d??termine les propri??t??s chimiques d'un ??l??ment; et ce est pour cette raison qu'un ??l??ment peut ??tre d??fini comme constitu?? d'un m??lange quelconque d'atomes ayant un num??ro atomique donn??e.
Nouveaux ??l??ments
La qu??te de nouveaux ??l??ments est habituellement d??crit en utilisant des num??ros atomiques. En 2010, des ??l??ments ayant les num??ros atomiques 1-118 ont ??t?? observ??s. Synth??se de nouveaux ??l??ments est r??alis??e par bombardement de cibles atomes d'??l??ments lourds avec des ions, de telle sorte que la somme des num??ros atomiques des ??l??ments de cible et d'ions ??gal au nombre atomique de l'??l??ment en cours de cr??ation. En g??n??ral, la demi-vie est plus courte que le num??ro atomique augmente, si un " ??lot de stabilit?? "peut exister pour les isotopes non d??couvertes avec certains nombres de protons et de neutrons.

